
Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Liek LM11A-31 v skúšaní spomaľuje progresiu Alzheimerovej choroby
Posledná kontrola: 02.07.2025

V nedávnej štúdii publikovanej v časopise Nature Medicine vedci vykonali randomizovanú, dvojito zaslepenú, placebom kontrolovanú štúdiu fázy 2a, aby preskúmali bezpečnosť a účinnosť LM11A-31 pri liečbe Alzheimerovej choroby (AD) prostredníctvom modulácie neurotrofínového receptora p75 (p75NTR).
Alzheimerova choroba s neskorým nástupom je najčastejšou formou demencie, ktorá sa vyznačuje synaptickým zlyhaním, degeneráciou a stratou nervových buniek. Hoci dva hlavné lieky na liečbu Alzheimerovej choroby sa zameriavajú na akumuláciu abnormálnych amyloidných-β alebo tau proteínov, riešia iba časť patofyziológie. Ďalší prístup zahŕňa zacielenie na receptory a signálne siete, ktoré ovplyvňujú základné biologické dráhy. Predklinické štúdie ukazujú, že modulácia p75NTR novou malou chemickou molekulou LM11A-31 znižuje synaptickú stratu spôsobenú amyloidom a abnormálnym tau proteínom.
Popis štúdie
V tejto randomizovanej klinickej štúdii výskumníci skúmali, či by LM11A-31 mohol spomaliť progresiu Alzheimerovej choroby moduláciou p75NTR u ľudí.
Účastníci štúdie dostávali 242 pacientov s miernou až stredne ťažkou astmou perorálne kapsuly LM11A-31 v dávkach 200 mg a 400 mg alebo placebo v pomere 1:1:1 počas 26 týždňov. Účastníci mali biologicky potvrdenú Alzheimerovu chorobu (hladina amyloidného β proteínu 42 (Aβ42) v mozgovomiechovom moku pod 550 ng/l alebo pomer Aβ42:β40 pod 0,89) diagnostikovanú podľa McKhannových kritérií, so skóre MMSE (Mini-Psychiatrické vyšetrenie) 18 až 26, skóre na Geriatrickej škále depresie (GDS) pod 5,0, skóre na modifikovanej Hachinského ischemickej škále (HIS) ≤ 4,0, formálne vzdelanie ≥ 8 rokov a predchádzajúci kognitívny pokles ≥ 6 mesiacov.
Účastníci, ktorí spĺňali podmienky pre zaradenie do štúdie, užívali inhibítory acetylcholínesterázy (AChEI) alebo čiastočné antagonisty NMDA receptorov ≥ 3 mesiace pred zaradením do štúdie. Neužívali nelegálne drogy, ako sú antipsychotiká, benzodiazepíny, antiepileptiká, sedatíva, centrálne účinné antihypertenzíva, nootropiká (okrem ginkgo biloby) ani analgetiká obsahujúce opioidy.
Primárnym výsledkom štúdie bola bezpečnosť a znášanlivosť, hodnotené pomocou stupnice hodnotenia závažnosti samovražedných myšlienok a správania Columbia (C-SSRS), vitálne funkcie, krvný tlak a hematologické parametre. Na posúdenie sekundárnych kognitívnych výsledkov sa použila štrukturálna magnetická rezonancia (cMRI), fluorodeoxyglukózová pozitrónová emisná tomografia (FDG-PET) a biomarkery mozgovomiechového moku (CSF). Medzi miery AD patril Thr181-fosforylovaný tau proteín, celkový tau proteín, Aβ40, Aβ42 a aktivita AChE. Tím použil prispôsobený neuropsychologický test na posúdenie sekundárnych kognitívnych výsledkov na začiatku, v 12. a 26. týždni.
Výsledky výskumu
Štúdia zistila, že LM11A-31 je bezpečný a dobre tolerovaný bez významných bezpečnostných problémov. Medzi najčastejšie nežiaduce účinky patrili bolesť hlavy, hnačka, eozinofília a nazofaryngitída, pričom gastrointestinálne problémy a eozinofília boli hlavnými dôvodmi na prerušenie liečby. V skupine s dávkou 400 mg bolo viac prerušení liečby v porovnaní so skupinami s dávkou 200 mg a placebom. MRI neodhalilo žiadne bezpečnostné problémy vrátane abnormalít súvisiacich s amyloidom. Medzi týmito dvoma liečebnými skupinami sa nezistili žiadne významné rozdiely v kognitívnom skóre ani v abnormalitách amyloidu.
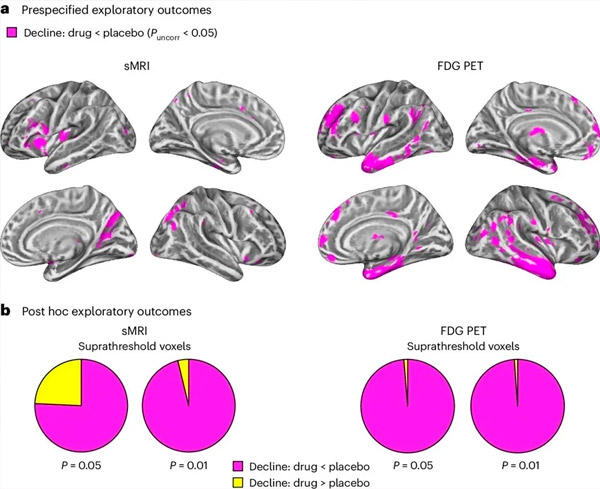
A. Dvojcestná zmiešaná modelová analýza kovariancie skúmala interakcie medzi liečbou (liek alebo placebo) a časom (pred alebo po liečbe). Jednostranný t-kontrast skúmajúci hypotézu interakcie (liek spomaľuje progresiu v porovnaní s placebom) ukázal, že liečba LM11A-31 spomalila longitudinálnu degeneráciu (ľavé panely) a hypometabolizmus glukózy (pravé panely) v skupine s liekom (cMRI, n = 127; PET, n = 121) v porovnaní so skupinou s placebom (cMRI, n = 66; PET, n = 62). Voxely ukazujúce túto interakciu sú zobrazené pri nekorigovanom prahu P < 0,05 (purpurová) na populačne špecifickom kortikálnom povrchu. Ľavá a pravá hemisféra sú zobrazené v hornom a dolnom riadku. Oblasti mozgu vykazujúce interakcie, ktoré nie sú v súlade s hypotézou, sú zobrazené na obrázku 7 v doplnkových údajoch.
B. Celkový počet voxelov vo vopred definovaných zraniteľných oblastiach mozgu s Alzheimerovou chorobou (celková plocha koláčových grafov) vykazujúci buď interakciu v súlade s hypotézou (purpurová), alebo interakciu, ktorá nie je v súlade s hypotézou (žltá) v každej zobrazovacej modalite (cMRI, ľavý panel; FDG PET, pravý panel) pri čoraz liberálnejších prahových hodnotách nekorigovaného P < 0,01 a P < 0,05. Simulácie Monte Carlo ukázali, že pomery voxelov vykazujúcich účinky v súlade s hypotézou oproti tým, ktoré nie sú v súlade s hypotézou, boli významne vyššie ako tie, ktoré boli pozorované na základe náhodne generovaných údajov pre cMRI aj PET (P < 0,001 pre každú modalitu; obojstranný test).
LM11A-31 účinne znížil nárast Aβ42 a Aβ40 v mozgovomiechovom moku v porovnaní s placebovou skupinou. Liek tiež preukázal zníženie mediánovej ročnej percentuálnej zmeny presynaptického proteínového biomarkera SNAP25 a zníženie postsynaptického biomarkera NG, čo naznačuje spomalenie straty presynaptických a postsynaptických spojení. LM11A-31 tiež znížil nárast YKL40, čo viedlo k zníženiu skóre MMSE a zvýšeniu skóre ADAS-Cog-13. Liek tiež znížil stratu sivej hmoty vo frontálnom laloku a zadnom parietálnom kortexe a zníženie metabolizmu glukózy v oblastiach, ako je entorhinálny kortex, temporálny kortex, hipokampus, insulárny kortex a prefrontálny kortex.
Záver
Štúdia dospela k záveru, že modulácia p75NTR pomocou LM11A-31 je vhodná pre rozsiahlejšie klinické štúdie. LM11A-31 splnil primárny bezpečnostný ukazovateľ a bol dobre tolerovaný pacientmi s miernou až ťažkou Alzheimerovou chorobou. Výsledky naznačujú potrebu ďalších štúdií s dlhším trvaním liečby na vyhodnotenie potenciálu malých molekúl regulovať p75NTR ako liečbu modifikujúcu ochorenie pri Alzheimerovej chorobe. Štúdia ukázala, že LM11A-31 významne ovplyvnil niekoľko biomarkerov vrátane Aβ40, Aβ42, SNAP25, NG a YKL40, čo naznačuje spomalenie patologickej progresie. Budúce štúdie môžu vyhodnotiť ďalšie ukazovatele zdravia gliových buniek.
