
Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Úloha zmien v subchondrálnej kosti v patogenéze osteoartrózy
Lekársky expert článku
Posledná kontrola: 04.07.2025
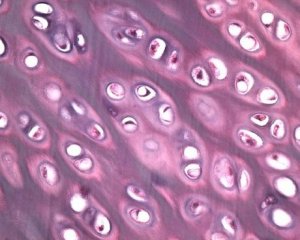
Spolu s degeneráciou kĺbovej chrupavky sa do patologického procesu pri osteoartróze zapája aj podkladové kostné tkanivo. Predpokladá sa, že zhrubnutie subchondrálnej platničky prispieva k progresii osteoartrózy. S postupujúcou osteoartrózou sa kĺbová chrupavka, ktorá je vystavená mechanickému a chemickému namáhaniu, pomaly eroduje v dôsledku nerovnováhy v procesoch katabolizmu a reparácie chrupavky. Najmä mechanické namáhanie vo vzťahu ku kĺbom „nesúcim“ telesnú hmotnosť prispieva k tvorbe veľkého počtu mikrofraktúr v subchondrálnej platničke a chrupavke. S eróziou kĺbovej chrupavky dochádza k postupu sklerózy subchondrálnej kosti, zvyšuje sa rigidita kostného tkaniva, čo následne prispieva k ďalšiemu narušeniu štruktúry kĺbovej chrupavky. Otázka primárnej alebo sekundárnej povahy zmien subchondrálnej kosti pri osteoartróze však zostáva nevyriešená.
Až donedávna boli rádiograficky detekovateľné zmeny v hubovitej substancii subchondrálnej kosti, ako je skleróza alebo tvorba cýst, u pacientov s osteoartrózou považované za sekundárne. Výsledky klinických a experimentálnych štúdií však naznačujú možnú iniciačnú úlohu subchondrálnej kosti v patogenéze osteoartrózy. Jedným z možných mechanizmov je prudký nárast gradientu tuhosti subchondrálnej kosti v dôsledku skutočnosti, že integrita podkladového chrupavkového tkaniva závisí od mechanických vlastností jej kostného „lôžka“. Štúdie na primátoch ukázali, že zmeny v subchondrálnej kosti môžu predchádzať zmenám v kĺbovej chrupavke. Dôkazy pre a proti tejto hypotéze, ktoré sa objavili v dôsledku štúdií na zvieracích modeloch osteoartrózy a klinických štúdií, len zintenzívnili diskusiu. Zhrubnutie trabekúl v subchondrálnej kosti nie je vždy sprevádzané zvýšením mineralizácie kostí, alebo skôr zvýšením objemu osteoidu. Tento znak abnormálnej mineralizácie naznačuje, že porucha regulácie prestavby kostí je neoddeliteľnou súčasťou osteoartrózy a tiež podporuje koncepciu defektu kostných buniek pri osteoartritíde. Skupina J. Dequekera (1989) považuje túto koncepciu za „generalizované metabolické ochorenie kostí“.
Kostné tkanivo sa neustále obnovuje. Tento dynamický proces, nazývaný remodelácia kostí, je komplexná sekvencia resorpcie a mineralizácie. Osteoklasty resorbujú kostné tkanivo a osteoblasty vylučujú proteíny, ktoré tvoria hlavnú organickú zložku mineralizácie. Tvorba a resorpcia kostí neprebiehajú v celej kostre náhodne; je to naprogramovaný proces, ktorý prebieha v rôznych oblastiach kostry, nazývaných jednotky remodelácie kostí. Na začiatku cyklu sa osteoklasty objavujú na neaktívnom povrchu; do 2 týždňov vytvoria tunel v kortikálnej kosti alebo lakunu na povrchu trabekulárnej kosti. Frekvencia aktivácie nových jednotiek remodelácie kostí určuje stupeň obnovy kostí. U zdravého mladého človeka sú procesy tvorby a resorpcie kostí vyvážené a udržiava sa normálna kostná hmota. Na hormonálnej regulácii resorpcie kostného tkaniva, prinajmenšom PTH a PGE2 , sa podieľajú nielen osteoklasty, ale aj osteoblasty, pretože pod vplyvom týchto hormónov sa uvoľňujú faktory stimulujúce resorpciu kostí osteoklastmi. V súčasnosti je známych viac ako 12 lokálnych a systémových regulátorov rastu kostného tkaniva, ktoré ovplyvňujú jeho remodeláciu, najmä PTH, 1,25(OH)2D3 ,kalcitonín, rastový hormón, glukokortikoidy, hormóny štítnej žľazy, inzulín, IGF (1 a 2), estrogény, PGE2 , androgény.
Kostné bunky uvoľňujú množstvo proteínov a cytokínov, ktoré vykonávajú endokrinnú reguláciu a prenos signálu. Medzi proteíny produkované osteoblastmi patria proteíny kostnej matrice, ako je kolagén, osteopontín, osteokalcín, kostné sialoproteíny. Okrem toho tieto bunky uvoľňujú proteázy v aktívnej aj latentnej forme, ktoré sa podieľajú na procese prestavby kostného tkaniva – MMP, zložky systému aktivátor plazminogénu (PA)/plazmín. Cytokíny uvoľňované osteoblastmi môžu pôsobiť na lokálne bunky (iné osteoblasty, osteoklasty) autokrinnými mechanizmami aj parakrinnými dráhami.
Zatiaľ nie je známe, či sú tieto signály regulované mechanickým stresom alebo inými chemickými signálmi vyvolanými mechanickým stresom. Je však známe, že opakovaný mechanický stres spôsobuje lokálnu proliferáciu kostných buniek a/alebo proteínov. In vivo môže mechanické zaťaženie aktivovať osteoblasty, zvýšiť hladinu cyklických nukleotidov, produkciu prostaglandínov a spôsobiť morfologické zmeny spojené s prestavbou kostí. In vitro mechanický stres spôsobuje proliferáciu osteoblastových kultúr, expresiu mRNA kostných proteínov zapojených do tvorby a mineralizácie osteoidov, uvoľňovanie lokálnych rastových faktorov, ako sú IGF-1 a IGF-2, a adhéznych molekúl. Prenos signálu mechanického stresu sa môže uskutočňovať prostredníctvom mechanosenzitívnych iónových kanálov.
Existujú nepriame dôkazy o dysfunkcii osteoblastov pri osteoartróze. G. Gevers a J. Dequeker (1987) preukázali zvýšenie hladín osteokalcínu v sére u žien s osteoartrózou ruky, ako aj v kortikálnych kostných explantátoch, čo naznačuje, že kostná patológia môže byť súčasťou osteoartrózy. Pitva odhalila nielen zhrubnutie subchondrálnej kosti, ale aj abnormálne nízku mineralizáciu hlavice stehennej kosti. U morčiat s chirurgicky indukovanou osteoartrózou odhalila počítačová tomografia významné zhrubnutie kostnej frakcie v subchondrálnej zóne. Nerovnováha medzi kolagénovými a nekolagénovými (osteokalcín atď.) proteínmi môže viesť k zvýšeniu objemu kosti, ale neovplyvňuje jej minerálnu hustotu. Podľa M. Shimizu a kol. (1993) je progresia degeneratívnych zmien v kĺbovej chrupavke spojená s intenzívnejšou remodeláciou subchondrálnej kosti a zvýšením jej rigidity, čo tiež naznačuje defekt buniek kostného tkaniva pri osteoartróze. Podľa hypotézy, ktorú navrhli B. Lee a M. Aspden (1997), môže proliferácia defektných kostných buniek viesť k zvýšeniu tuhosti kostného tkaniva, ale nespôsobuje zvýšenie jeho minerálnej hustoty.
CI Westacott a kol. (1997) predpokladali, že abnormálne osteoblasty priamo ovplyvňujú metabolizmus chrupavky. Pri kultivácii osteoblastov od pacientov s osteoartrózou s chondrocytmi od ľudí, ktorí nemali ochorenia kĺbov, autori pozorovali významnú zmenu v uvoľňovaní glykozaminoglykánov normálnym chrupavkovým tkanivom in vitro, ale hladina uvoľňovania cytokínov zostala nezmenená. G. Hilal a kol. (1998) ukázali, že kultúra osteoblastov zo subchondrálnej kosti pacientov s osteoartrózou in vitro má zmenený metabolizmus - aktivita systému AP/plazmín a hladina IGF-1 v týchto bunkách sú zvýšené. Pozorovanie CI Westacott a kol. (1997) možno vysvetliť zvýšením aktivity proteáz v bunkách subchondrálnej kosti.
Zostáva neznáme, či zmeny v subchondrálnej kosti iniciujú osteoartrózu alebo prispievajú k jej progresii. DK Dedrick a kol. (1993) preukázali, že u psov s chirurgicky vyvolanou osteoartrózou nie je zhrubnutie subchondrálnej kosti nevyhnutnou podmienkou pre rozvoj zmien podobných osteoartróze v kĺbovej chrupavke, ale prispieva k progresii degeneratívnych procesov v chrupavke. Výsledky štúdie A. Sa'ieda a kol. (1997) sú v rozpore s údajmi z predchádzajúcej štúdie. Autori pomocou 50 MHz echografie posúdili počiatočné morfologické zmeny a ich progresiu v kĺbovej chrupavke a kosti pri experimentálnej osteoartritíde vyvolanej injekciami kyseliny monojódoctovej do kolenného kĺbu potkanov a preukázali simultánny proces zmien v kosti a chrupavke počas prvých troch dní po injekcii.
Osteoblasty vylučujú rastové faktory a cytokíny zapojené do lokálnej prestavby kostí, ktoré môžu podporovať prestavbu vlastnej chrupavky v „nosných“ kĺboch po ich preniknutí cez mikrotrhliny v kalcifikovanej vrstve kĺbovej chrupavky. Okrem toho sa v synoviálnej tekutine nachádzajú sekrečné produkty kostných buniek. Najpravdepodobnejšími produktmi vylučovanými abnormálnymi osteoblastmi, ktoré môžu iniciovať proces lokálnej prestavby chrupavky, sú TGF-β a kostné morfometrické proteíny (BMP). Oba členovia rodiny TGF sú vylučované chondrocytmi aj osteoblastmi a oba sú schopné modifikovať prestavbu kostí aj chrupavky. J. Martel Pelletier a kol. (1997) pozorovali zvýšenie hladiny TGF-β v subchondrálnych kostných explantátoch pacientov s osteoartrózou v porovnaní so zdravými jedincami, čo naznačuje pravdepodobnú úlohu tohto rastového faktora v patogenéze osteoartrózy. IGF sú tiež produkované osteoblastami. V kultúre buniek podobných osteoblastom získaných od pacientov s osteoartrózou sa zistilo zvýšenie hladiny IGF, ktoré menia metabolizmus chrupavky.
TGF-b, IGF, BMP a cytokíny produkované osteoblastmi v subchondrálnej kosti môžu ovplyvňovať produkciu kolagenázy a iných proteolytických enzýmov v chrupavke, čo môže následne podporovať remodeláciu/degradáciu chrupavkovej matrice. Zostáva nejasné, či osteoblasty pri osteoartritíde produkujú menej faktora stimulujúceho kolónie makrofágov (M-CSF - stimulátor resorpcie kostí) ako normálne bunky. Výsledky štúdií AG Uitterlindena a kol. (1997) ukázali, že receptory vitamínu D, ktoré sú exprimované osteoblastmi a regulujú expresiu mnohých faktorov syntetizovaných týmito bunkami, môžu zohrávať určitú úlohu pri tvorbe osteofytov, čo čiastočne vysvetľuje úlohu osteoblastov v patogenéze tohto ochorenia.
Vzhľadom na výsledky vyššie uvedených štúdií G. Hilal a kol. (1998), J. Martel-Pelletier a kol. (1997) navrhli nasledujúcu pracovnú hypotézu o vzťahu medzi remodeláciou subchondrálnej kosti a vlastnou kĺbovou chrupavkou pri osteoartróze. V skorom alebo pokročilom štádiu patogenézy osteoartrózy sa proces remodelácie kostného tkaniva v subchondrálnej kosti zintenzívňuje. Zároveň opakované zaťaženie vedie k lokálnym mikrofraktúram a/alebo k vzniku nerovnováhy v systéme IGF/IGF-viažuci proteín (IGFBP) v dôsledku abnormálnej odpovede osteoblastov subchondrálnej kosti, čo prispieva k jej skleróze. Tá môže zase prispieť k vzniku mikrofraktúr vlastnej chrupavky a poškodeniu jej matrice.
Za normálnych podmienok sa toto poškodenie opraví lokálnou syntézou a uvoľňovaním IGF-1 a IGF-viažuceho proteínu, ktoré stimulujú tvorbu ECM kĺbovej chrupavky. Zároveň GF systém podporuje rast subchondrálnych kostných buniek a tvorbu kostnej matrice. Anabolická aktivita IGF systému je zvýšená v subchondrálnej kosti pacientov s osteoartrózou, zatiaľ čo lokálna aktivácia AP/plazmínového systému (lokálny regulátor IGF systému) v kĺbovej chrupavke spôsobuje jej lokálne zmeny. V osteoblastoch pri osteoartróze IGF-1 narúša reguláciu AP plazmínom typom pozitívnej spätnej väzby, a preto môže obmedzovať remodeláciu v kostnom tkanive, čo v konečnom dôsledku vedie k subchondrálnej skleróze. V kostnom a chrupavkovom tkanive teda lokálna indukcia IGF-1 a proteáz vedie na jednej strane k poškodeniu chrupavky a na druhej strane k zhrubnutiu subchondrálnej kosti, čo zase prispieva k ďalšiemu poškodeniu chrupavky. Nerovnováha medzi poškodením chrupavky spojeným so subchondrálnou sklerózou a jej reparačnými schopnosťami vedie k progresívnym zmenám v extracelulárnom médiu chrupavky a k rozvoju osteoartrózy. Podľa autorov táto hypotéza vysvetľuje aj pomalú progresiu ochorenia.

