
Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Genetické a metabolické aspekty patogenézy osteoartrózy
Lekársky expert článku
Posledná kontrola: 08.07.2025
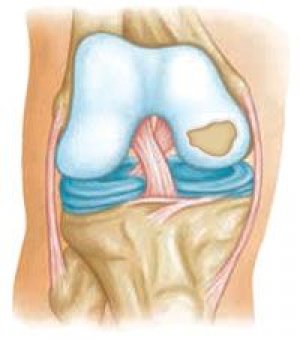
Úloha mechanických faktorov v patogenéze osteoartrózy je nepopierateľná, existujú však presvedčivé dôkazy o tom, že niektoré formy osteoartrózy sa dedia podľa Mendelových zákonov. Dedičné osteoartrózy možno rozdeliť na:
- primárna generalizovaná osteoartróza (PGAO),
- artropatie spojené s kryštálmi,
- predčasná osteoartróza v dôsledku dedičnej osteochondrodysplázie.
V roku 1803 W. Heberden opísal „mierne husté uzliny, veľkosti malého hrášku“ na dorzálnej ploche distálnych interfalangeálnych kĺbov rúk. Tento príznak podľa autora odlišuje osteoartrózu od iných ochorení kĺbov vrátane dny. J. Hayagarth (1805) rozšíril klinický popis Heberdenových uzlín a zaznamenal ich častú súvislosť s artrózou iných lokalizácií. Neskôr Bouchard opísal podobné uzliny na dorzálnej ploche proximálnych interfalangeálnych kĺbov rúk. W. Osier pomocou termínu „Heberdenove a Bouchardove uzliny“ rozlíšil „hypertrofickú artritídu“ a „deformujúcu sa artritídu“ (1909). V roku 1953 R. M. Stecher a H. Hersh objavili prevalenciu Heberdenových uzlín medzi členmi rodiny a dospeli k záveru, že sa dedia autozomálne dominantným spôsobom. Následné štúdie po objave R. M. Stechera a H. Hersha odhalili súvislosť Heberdenových a Bouchardových uzlín s degeneratívnymi léziami iných kĺbov. Na základe údajov z klinického vyšetrenia a HLA typizácie JS Lawrence (1977), JS Lawrence a kol. (1983) naznačili skôr prítomnosť polygénnej dedičnosti ako defekt jedného génu.
Fenotypové spektrum dedičnej osteoartrózy sa značne líši od miernych foriem, ktoré sa klinicky prejavia až v neskorej dospelosti, až po veľmi závažné formy, ktoré sa prejavujú v detstve. Tradične sa všetky tieto formy klasifikujú ako sekundárna osteoartróza. V súčasnosti je známe, že niektoré z týchto fenotypov sú spôsobené mutáciami v génoch kódujúcich makromolekuly extracelulárnej membrány kĺbovej chrupavky (ECM), ktoré narúšajú integritu chrupavkovej matrice a reguláciu proliferácie chondrocytov a génovej expresie. Tieto dedičné ochorenia predstavujú samostatnú podskupinu osteoartrózy, ktorá sa líši od sekundárnej osteoartrózy.
Rozdiely medzi dedičnou a sekundárnou osteoartrózou (podľa Williamsa CJ a Jimeneza SA, 1999)
Dedičná osteoartróza |
Sekundárna osteoartritída |
|
Etiológia |
Mutácia génov exprimovaných v kĺbovej chrupavke |
Rôzne dedičné a získané choroby |
Patogenéza |
Poškodenie štrukturálnych alebo funkčných zložiek kĺbovej chrupavky |
Sekundárne prejavy ochorenia, ktoré nie vždy postihujú iba kĺbovú chrupavku |
Liečba |
Génová terapia môže byť možná na korekciu génovej chyby |
Liečba základného ochorenia |
Chondrodysplázia/osteochondrodysplázia je skupina klinicky heterogénnych ochorení charakterizovaných abnormalitami v raste a vývoji kĺbovej chrupavky a rastovej platničky. Niektoré CD/OCD vedú k skorému rozvoju osteoartrózy, klinicky charakterizovanej závažným priebehom. Medzi nimi možno rozlíšiť nasledujúce ochorenia:
- spondyloepifyzeálna dysplázia (SED),
- Sticklerov syndróm,
- dysplázia Knista,
- mnohopočetná epifyzárna dysplázia (MED),
- metafyzeálna chondrodysplázia (MCD),
- niektoré oto-spondylo-meta-epifyzeálne dysplázie (OSMED).
Hereditárne dysplázie charakterizované skorým nástupom osteoartrózy (podľa Williamsa CJ a Jimeneza SA, 1999)
Choroba |
Miesto |
Typ dedičstva |
Mutovaný gén |
Typ mutácie |
Včasná osteoartritída s neskorým nástupom SED (OAR)* |
12q13.1-q13.2 |
PEKLO |
STĹPEC 2 A, |
Substitúcia, inzercia, delécia báz |
Sticklerov syndróm (STL1) |
12q13.1-q13.2 |
PEKLO |
COL2A1 |
Výmena základne, vloženie |
Sticklerov syndróm (STL2) |
6p21.3 |
PEKLO |
KOLA |
Vloženie, vymazanie |
Sticklerov syndróm |
1p21 |
PEKLO |
KOLA |
Výmena základne |
Wagnerov syndróm |
12q13.1-q13.2 |
PEKLO |
COUA, |
Výmena základne |
OSMED |
6p21.3 |
Rozšírená realita |
KOLA |
Výmena základne |
Marshallov syndróm |
1p21 |
PEKLO |
KOLA |
Vložiť |
Knista dysplázia |
12q13.1-q13.2 |
PEKLO |
KOLA |
Vloženie, vymazanie |
M3fl(EDM1) |
19p13.1 |
PEKLO |
KOMP |
Výmena základne |
MED (EDM 2) |
1р32,2-рЗЗ |
PEKLO |
KOLA |
Vložiť |
MCDS |
6q21-q22.3 |
PEKLO |
KOLA |
Substitúcia, delécia báz |
MCDJ Jansen |
Зр21.2-р21.3 |
PEKLO |
PTHR, |
Výmena základne |
*Symboly lokusov sú uvedené v zátvorkách; AD - autozomálne dominantné; AR - autozomálne recesívne.
Spondylofyzeálna dysplázia
Spondyloepifyzeálne dysplázie (SED) zahŕňajú heterogénnu skupinu ochorení s autozomálne dominantným typom dedičnosti, ktoré sa vyznačujú abnormálnym vývojom axiálneho skeletu a závažnými zmenami v epifýzach dlhých tubulárnych kostí, často spôsobujúcimi nanizmus. SED má často závažný klinický priebeh, sprevádzaný skrátením tela a v menšej miere aj končatín.
Pri formách EDS, ktoré sa prejavujú v neskoršom veku, je fenotyp často málo zmenený a klinicky sa nemusí prejaviť až do adolescencie, kedy sa vyvinie ťažká osteoartróza. Deformácia bedrovej chrbtice sa môže prejaviť ako zúženie medzistavcových platničiek, platyspondylia a mierna kyfoskolióza. Zistia sa aj anomálie epifýz v periférnych kĺboch a skoré degeneratívne zmeny v nich. Najkonštantnejším znakom poškodenia periférnych kĺbov je sploštenie kĺbových plôch členkových a kolenných kĺbov, ako aj sploštenie interkondylárnej drážky stehennej kosti. Anomálie hlavy a krčka stehennej kosti sa často zisťujú s rozvojom osteoartrózy bedrového kĺbu, ktorá sa prejavuje v adolescencii.
Keďže kolagén typu II je hlavnou zložkou ECM hyalínovej chrupavky, predpokladá sa, že príčinou EDS je gén COL1A, ktorý ho kóduje. Prvý popis genetickej súvislosti medzi fenotypom skorej osteoartrózy spojenej s neskorým nástupom EDS a génom prokolagénu typu II, COL 2 A, pochádza z rokov 1989 a 1990. Prvá správa o mutácii COL 2 A u príbuzných s skorou osteoartrózou spojenou s neskorým nástupom EDS zahŕňala substitúciu bázy Arg519>Cys. Doteraz boli identifikované ďalšie štyri rodiny s podobnými mutáciami. U členov inej rodiny s skorou osteoartrózou a miernym EDS bola zistená substitúcia bázy Arg75>Cys, hoci fenotyp EDS u členov tejto rodiny nie je podobný fenotypu rodiny so substitúciou arginínu za cysteín v pozícii 519. U členov rodín s EDS boli zistené aj ďalšie mutácie COL 2 A-Gly976>Ser, Gly493>Ser. J. Spranger a kol. (1994) použili termín „kolagenopatia typu 11“ na opis dedičných ochorení chrupavkového tkaniva s primárnou mutáciou v géne prokolagénu typu II COL1A.
Klasická forma Sticklerovho syndrómu
Prvýkrát ho opísal v roku 1965 GB Stickler a kolegovia, ktorí ho nazvali dedičnou artro-oftalmopatiou. Syndróm opísaný GB Sticklerom bol charakterizovaný zrakovým postihnutím a závažným degeneratívnym ochorením kĺbov, ktoré sa zvyčajne vyvíja v tretej alebo štvrtej dekáde života. Ide o autozomálne dominantné ochorenie s incidenciou približne 1 z 10 000 živonarodených detí. Klinický obraz zahŕňa krátkozrakosť, progresívnu hluchotu, rázštep podnebia, hypopláziu mandibuly (Pierre-Robinova anomália) a hypopláziu epifýz. V novorodeneckom období röntgenové snímky pacientov so Sticklerovým syndrómom odhaľujú zväčšené epifýzy, predovšetkým proximálny femur a distálnu tibiu. Počas rastu sa vyvíja epifyzeálna dysplázia, ktorá sa prejavuje nepravidelnou osifikáciou epifýz a následnými degeneratívnymi zmenami.
Keďže COL 2 A je exprimovaný v kĺbovej chrupavke a sklovci očnej buľvy, výskyt Sticklerovho syndrómu bol spojený s patológiou tohto génu. Vyšetrenie niekoľkých rodín so Sticklerovým syndrómom však ukázalo, že nie všetky rodiny majú ochorenie spojené s COL 2 A. Táto forma ochorenia sa nazýva Sticklerov syndróm typu I (lokusový symbol STL1).
Spektrum klinických prejavov Sticklerovho syndrómu sa značne líši a doteraz bolo identifikovaných niekoľko fenotypov. Medzi nimi je Wagnerov syndróm, ktorý sa vyznačuje prevahou poškodenia očnej buľvy; osteoartróza pri Wagnerovom syndróme sa prakticky nikdy nevyvíja, hoci u pacientov bola identifikovaná mutácia génu COL 2 A (substitúcia báz Gly67>Asp). Zostáva nejasné, prečo takáto mutácia COL ohrozuje iba funkciu sklovca a neovplyvňuje hyalínovú chrupavku.
Ďalšou formou Sticklerovho syndrómu je tzv. holandský variant; vyznačuje sa všetkými klasickými prejavmi syndrómu okrem zrakového poškodenia. HG Brunner a kol. (1994) preukázali, že holandský fenotyp Sticklerovho syndrómu je spojený s mutáciou v géne COL,,A2 : dominantnou mutáciou je delécia 54 bázových párov, po ktorej nasleduje delécia exónu. M. Sirko-Osadsa a kol. (1998) uviedli ďalšiu rodinu, nesúvisiacu s tou, ktorú opísali predchádzajúci autori, s podobným fenotypom a mutáciou v géne COL,,A2 ( delécia 27 bázových párov), čo potvrdzuje údaje HG Brunnera a kol. (1994). Tento variant sa nazýva Sticklerov syndróm typu II (lokusový symbol STL1).
Nedávno bol u členov rodiny s patológiou sklovca a sietnice identifikovaný tretí lokus Sticklerovho syndrómu, ktorý sa fenotypovo významne líši od zmien pozorovaných v „klasickom“ variante syndrómu. U členov tejto rodiny bola zistená mutácia v géne COL2A| (substitúcia báz Gly97>Val). Na potvrdenie zistení A. J. Richardsa a kol. sú samozrejme potrebné nové opisy prípadov tohto feno- a genotypu Sticklerovho syndrómu.
Nozologická súvislosť medzi Marshallovým syndrómom a klasickou verziou Sticklerovho syndrómu sa diskutuje už dlho. V súčasnosti je Marshallov syndróm klasifikovaný ako samostatný fenotyp, najmä kvôli výraznejšej deformácii tvárovej kostry, hoci poškodenie periférnych kĺbov je podobné ako pri Sticklerovom syndróme typu I. Pri Marshallovom syndróme sa osteoartróza kolenných kĺbov a lumbosakrálnej chrbtice začína po 30 rokoch. Príčinou syndrómu je mutácia v géne kolagénu typu IX COL n A1.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ]
OSMED
Tento fenotyp bol opísaný v holandskej rodine, v ktorej sa v dospievaní objavili degeneratívne zmeny v kĺboch pripomínajúce osteoartrózu a postihli najmä bedrové, kolenné, lakťové a ramenné kĺby; zistili sa aj zvláštne črty tváre, zvýšená bedrová lordóza, zväčšené interfalangeálne kĺby a strata sluchu, ale nezistili sa žiadne zrakové anomálie (Vikkula M. a kol., 1995). Výskumníci zistili mutáciu v géne kódujúcom α2- reťazec kolagénu typu II COL,, A2.
Knista dysplázia
Charakterizované skrátením trupu a končatín, sploštením tváre a koreňa nosa, exoftalmom a závažnými abnormalitami kĺbov. U pacientov s Kniestovým syndrómom sa kĺby, zvyčajne veľké od narodenia, naďalej zväčšujú v detstve a ranej adolescencii. Často sa u nich vyskytuje aj krátkozrakosť, strata sluchu, rázštep podnebia a konská noha; u väčšiny pacientov sa v ranom štádiu vyvinú závažné degeneratívne zmeny, najmä výrazné v kolenných a bedrových kĺboch. Röntgenové snímky chrbtice odhaľujú sploštenie a výrazné predĺženie stavcov a platyspondyliu. Dlhé rúrkovité kosti sú deformované ako činka a osifikácia epifýz je pomalá. V kĺboch rúk sú epifýzy sploštené a kĺbové štrbiny zúžené. Kĺbová chrupavka je mäkká, jej elasticita je znížená; histologicky sa v nej nachádzajú veľké cysty (príznak „švajčiarskeho syra“). Kniestov syndróm je spôsobený mutáciou v géne prokolagénu typu II COb2A1.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ]
Mnohopočetná epifýzová dysplázia (MED)
Heterogénna skupina ochorení charakterizovaná abnormálnym vývojom rastových platničiek dlhých rúrkovitých kostí, ako aj skorou (prejavujúcou sa v detstve) ťažkou osteoartrózou postihujúcou axiálne aj periférne kĺby (najčastejšie kolenné, bedrové, ramenné a kĺby rúk). Klinicky sa MED prejavuje ako bolesť a stuhnutosť kĺbov, zmeny v chôdzi. Pacienti s MED majú tiež minimálne zmeny v chrbtici (rôzne stupne sploštenia stavcov), niekedy je chrbtica neporušená. Charakteristický je aj nízky vzrast pacientov, hoci nanizmus sa vyvíja zriedkavo. Zrakový orgán nie je postihnutý. MED zahŕňa niekoľko variantov, napríklad Fairbanksov a Ribbingov fenotyp.
MED sa dedia autozomálne dominantným spôsobom s rôznym stupňom penetrancie. Keďže charakteristickým znakom MED je anomália epifyzeálnej rastovej platničky, predpokladá sa, že tieto dysplázie sú spôsobené defektom v génoch kódujúcich makromolekuly chrupavky rastovej platničky. Ukázalo sa, že s fenotypom MED sú spojené najmenej tri lokusy. Štúdie EJ Weavera a kol. (1993), JT Hechta a kol. (1992) vylúčili gény kolagénu typu II a VI, jadrový proteín proteoglykánov a spojivový proteín chrupavky zo zoznamu „vinníkov“ MED. JT Hecht a kol. (1993), R. Oehelmann a kol. (1994) zistili súvislosť medzi MED, ako aj klinicky súvisiacim syndrómom pseudoachondroplázie a pericentromérnou oblasťou chromozómu 19. Následné štúdie identifikovali mutáciu v géne kódujúcom proteín oligomérnej matrice chrupavky (OMMP) u troch pacientov s MED (lokusový symbol EDM1). Keďže všetky tri mutácie sa vyskytli v génovej oblasti kódujúcej doménu OMMP viažucu vápnik, je pravdepodobné, že funkcia tohto proteínu viažuca vápnik je nevyhnutná pre normálny vývoj chrupavky rastovej platničky.
MD Briggs a kol. (1994) uviedli holandskú rodinu s fenotypom MED asociovaným s oblasťou chromozómu 1 obsahujúcou jeden z génov kolagénu typu IX, COL1A1 (symbol lokusu EDM 2). Je pozoruhodné, že nájdená mutácia bola prvým dôkazom úlohy kolagénu typu IX, lokalizovaného na povrchu fibríl kolagénu II, pri udržiavaní integrity hyalínovej chrupavky. M. Deere a kol. (1995) preukázali, že fenotyp Fairbanks nebol geneticky asociovaný ani s lokusom EDM, ani s lokusom EDM2, čo potvrdzuje heterogenitu MED.
Metafyzeálna chondrodysplázia (MCD)
Heterogénna (bolo opísaných viac ako 150 typov) skupina dedičných ochorení hyalínovej chrupavky, ktoré sa klinicky prejavujú ako skorá osteoartróza. MHD sú charakterizované zmenami v kostných metafýzach. Klinicky sa prejavujú ako nízky vzrast, skrátené končatiny, krivé holene a „kačacia“ chôdza. Pacienti s MHD vykazujú aj známky poškodenia iných systémov (napríklad imunitného a tráviaceho systému). Pozoruje sa dezorganizácia chrupavky rastovej platničky, ktorá sa histologicky prejavuje ako zhluky proliferovaných a hypertrofovaných chondrocytov obklopených zhrubnutými septami a dezorganizovanou matricou, ako aj prenikanie nekalcifikovanej chrupavky do subchondrálnej kosti.
Jansenov, Schmidov a McKusickov syndróm sú najštudovanejšie MHD. Sú si podobné v znakoch skeletálnych anomálií, ale líšia sa závažnosťou (Jansenov syndróm-McKusickov syndróm-Schmidov syndróm). Najčastejší je Schmidov syndróm (symbol lokusu MCDS), ktorý sa dedí autozomálne dominantným spôsobom. Rádiologicky sa syndróm prejavuje coxa vara, skrátením a zakrivením tubulárnych kostí, miskovitou deformáciou metafýz (výraznejšia v proximálnej ako v distálnej časti stehennej kosti). Najvýraznejšie zmeny sa pozorujú v rastových platničkách dlhých tubulárnych kostí.
U pacientov so Schmidovým syndrómom bolo opísaných najmenej 17 rôznych typov mutácií génu kolagénu X. Kolagén X je exprimovaný v hypertrofovaných chondrocytoch rastových platničiek a môže byť zapojený do procesov osifikácie. Mutácia v géne kolagénu X COb2A1 je teda najpravdepodobnejšou príčinou Schmidového syndrómu.
Deti s Jansenovým syndrómom majú hyperkalcémiu, zvýšené hladiny fosfátov v moči a znížené hladiny parathormónu (PTH) a peptidu súvisiaceho s PT. Anomália posledného menovaného je pravdepodobne zodpovedná za rozvoj Jansenovho syndrómu. V roku 1994 AS Karaplis a spoluautori publikovali výsledky pôvodnej štúdie. Po narušení génu kódujúceho peptid súvisiaci s PT v myších embryonálnych kmeňových bunkách myši s deficitom tejto alely uhynuli ihneď po narodení. Zistila sa u nich anomália vo vývoji subchondrálnej kosti, zhoršený rast chrupavky a znížená proliferácia chondrocytov. V roku 1995 E. Schipani a spoluautori opísali heterozygotnú mutáciu v géne receptora PTH u pacienta s Jansenovým syndrómom. Mutácia pozostávala zo substitúcie bázy Gys223>Arg, čo viedlo k akumulácii cAMP; To znamená, že aminokyselina histidín v pozícii 223 hrá kľúčovú úlohu v prenose signálu. Neskôr E. Schipani a kol. (1996) uviedli troch ďalších pacientov s Jansenovým syndrómom, z ktorých dvaja mali podobnú mutáciu a tretí mal substitúciu TrА10>РrО.
Primárna generalizovaná osteoartróza
Najčastejšou dedičnou formou osteoartrózy je primárna generalizovaná osteoartróza (PGOA), ktorú ako samostatnú nozológiu prvýkrát opísali JH Kellgren a R. Moore v roku 1952. Klinicky je primárna generalizovaná osteoartróza charakterizovaná výskytom Bouchardových a Heberdenových uzlín, polyartikulárnych lézií. Primárna generalizovaná osteoartróza sa vyznačuje skorým nástupom manifestácie osteoartrózy a jej rýchlou progresiou. Rádiologicky sa primárna generalizovaná osteoartróza nelíši od nehereditárnej osteoartrózy. Napriek tomu, že otázka etiopatogenézy primárnej generalizovanej osteoartrózy je stále predmetom diskusií, štúdie preukazujú dôležitú úlohu dedičnej predispozície pri vzniku a progresii primárnej generalizovanej osteoartrózy.
JH Kellgren a kol. (1963) teda zistili Boucharay-Heberdenove uzliny u 36 % mužských príbuzných a 49 % ženských príbuzných, zatiaľ čo v bežnej populácii boli tieto čísla 17 a 26 %. U jedincov s primárnou generalizovanou osteoartrózou sa častejšie zisťuje haplotyp HLA A1B8 a izoforma MZ α1-antitrypsínu. V klasickej štúdii zahŕňajúcej dvojčatá vykonali TD Spector a kol. (1996) rádiografiu kolenných kĺbov a kĺbov rúk u 130 monozygotných a 120 dvojjazyčných dvojčiat ženského pohlavia na zistenie zmien charakteristických pre osteoartrózu. Ukázalo sa, že zhoda rádiografických znakov osteoartrózy všetkých lokalizácií bola u monozygotných dvojčiat 2-krát vyššia v porovnaní s dvojjazyčnými dvojčatami a príspevok genetických faktorov sa pohyboval od 40 do 70 %. Štúdia nodulárnej osteoartrózy od GD Wrighta a kol. (1997) preukázali skorý nástup ochorenia, vysokú závažnosť a negatívnu koreláciu medzi vekom nástupu ochorenia u pacientov a vekom počatia ich rodičov.
Spomedzi artropatií spojených s kryštálmi má ukladanie kryštálov kyseliny močovej a kryštálov obsahujúcich vápnik v kĺbovej dutine familiárnu predispozíciu.
Dedičné artropatie spojené s kryštálmi (podľa Williamsa CJ a Jimeneza SA, 1999)
Choroba |
Miesto |
Typ dedičstva |
Mutovaný gén |
Typ mutácie |
Dna (HPRT)* |
Xq27 |
X-viazaný |
HPRT1 |
Substitúcia, delécia báz |
Dna (PRPS) |
Xq22-q24 |
X-viazaný |
PRPS1 |
Výmena základne |
Primárna pyrofosfátová artropatia (CCAL1) |
5р15.1-р15.2 |
PEKLO |
? |
? |
Pyrofosfátová artropatia s včasným nástupom spojená s 0A (CCAL2) |
8q |
PEKLO |
? |
? |
*Symboly lokusov sú uvedené v zátvorkách; AD – autozomálne dominantné.
V roku 1958 D. Zintann S. Sitaj predstavil klinické popisy patológie, ktorú nazvali „chondrokalcinóza“, u 27 pacientov. Väčšina pacientov patrila do piatich rodín, čo naznačuje dedičnú zložku v etiopatogenéze ochorenia. Neskôr D. McCarty a JL Hollander (1961) informovali o dvoch pacientoch s podozrením na dnu s ukladaním kryštálov nenurátov v kĺbovej dutine. Röntgenové vyšetrenie odhalilo abnormálnu kalcifikáciu hyalínovej chrupavky mnohých kĺbov.
Rádiograficky sa ochorenie ukladania kryštálov dihydrátu pyrofosfátu vápenatého alebo pyrofosfátová artropatia podobá sporadickej osteoartróze, ale častejšie postihuje kĺby, ktoré nie sú typické pre bežné formy osteoartrózy (napr. metakarpofalangeálne, skaforadiálne, patelofemorálne kolenné kĺby). Pri pyrofosfátovej artropatii sa častejšie tvoria subchondrálne kostné cysty. Hoci vo väčšine prípadov sa chondrokalcinóza vyskytuje pred prejavom sekundárnej osteoartrózy, u niektorých jedincov môže ochorenie začať ako idiopatická osteoartróza, ktorá je sprevádzaná metabolickými poruchami (hemochromatóza, hyperparatyreóza, hypomagneziémia atď.).
S najväčšou pravdepodobnosťou štrukturálne zmeny v extracelulárnej hmote kĺbovej chrupavky (ECM) indukujú ukladanie kryštálov dihydrátu pyrofosforečnanu vápenatého. AO Bjelle (1972, 1981) zistil pokles obsahu kolagénu a fragmentáciu kolagénových vlákien v strednej zóne matrice kĺbovej chrupavky u členov švédskej rodiny s pyrofosforečnanovou artropatiou. Keďže tieto oblasti neobsahovali kryštály, autori predpokladali, že opísaná anomália matrice môže predisponovať k ich ukladaniu a rozvoju degeneratívnych zmien v kĺboch. Na základe štúdie sporadických prípadov pyrofosforečnanovej artropatie K. Ishikawa a kol. (1989), I. Masuda a kol. (1991) dospeli k záveru, že chondrokalcinóza je spôsobená mutáciou v génoch kódujúcich proteíny ECM. CJWilliams a kol. (1993), AJ Reginato a kol. (1994) zistili heterozygotnú mutáciu COL 2 A (substitúcia báz Argl5>Cys) u členov veľkej rodiny s klinickým fenotypom ťažkej skorej osteoartrózy s ankylózou, neskorým rozvojom spondyloepifyzeálnej dysplázie a chondrokalcinózy hyalínu a fibrokartilácie. Ukázalo sa však, že u členov tejto rodiny bola chondrokalcinóza sekundárna k osteoartritíde.
Taktiež sa predpokladá, že anorganické zložky extracelulárneho matrixu (ECM) prispievajú k tvorbe kryštálov. Napríklad hypomagnezémia spôsobuje chondrokalcinózu inhibíciou enzýmu pyrofosfatáza, čo následne znižuje rozpúšťanie kryštálov. V synoviálnej tekutine pacientov s pyrofosfátovou artropatiou boli zistené zvýšené hladiny anorganických fosfátov. Toto a ďalšie pozorovania naznačujú, že pacienti s pyrofosfátovou artropatiou majú lokálnu poruchu metabolizmu pyrofosfátov. Bol opísaný enzým nukleozidtrifosfátpyrofosfohydroláza, ktorý sa môže podieľať na tvorbe kryštálov pyrofosfátu v oblasti ich ukladania v ECM. Zvýšené hladiny tohto enzýmu boli zistené v sporadických prípadoch pyrofosfátovej artropatie, ale táto abnormalita nebola pozorovaná u familiárnych foriem ochorenia (Ryan LM a kol., 1986). Pri kultivácii fibroblastov a lymfoblastov od pacientov s familiárnou pyrofosfátovou artropatiou však bol zistený zvýšený obsah anorganických fosfátov, čo tiež potvrdzuje predpoklad o úlohe porúch lokálneho metabolizmu pyrofosfátu v patogenéze ochorenia.
V posledných rokoch sa uskutočnili pokusy o identifikáciu génov „vinných“ za výskyt familiárnych prípadov pyrofosfátovej artropatie. Analýza genetického materiálu získaného od členov veľkej rodiny s pyrofosfátovou artropatiou (Maine, USA), v ktorej sa chondrokalcinóza vyvinula sekundárne k ťažkej, rýchlo progredujúcej, nedysplastickej osteoartróze, vylúčila súvislosť medzi ochorením a lokusom COL 2. Autori tejto štúdie však zistili súvislosť medzi študovaným fenotypom pyrofosfátovej artropatie a lokusom nachádzajúcim sa na dlhom ramene chromozómu 8 (symbol lokusu CCAL). AG Hughes a kol. (1995) zistili súvislosť medzi fenotypom primárnej chondrokalcinózy v rodine z Veľkej Británie a lokusom CCAL1, ktorý je lokalizovaný na krátkom ramene chromozómu 5 v oblasti 5p15. Podľa CJ Williamsa a kol. (1996) sa lokus CCAL1 u členov argentínskej rodiny s pyrofosfátovou artropatiou nachádzal o niečo proximálnejšie ako v predchádzajúcom prípade, v oblasti 5p15.1. Podobný genotyp sa zistil u členov rodiny z Francúzska.
Údaje z opísaných štúdií teda naznačujú, že familiárna forma pyrofosfátovej artropatie je klinicky a geneticky heterogénne ochorenie, ktoré môže byť spôsobené mutáciami v najmenej troch rôznych génoch.

