
Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Patogenéza hepatitídy B
Lekársky expert článku
Posledná kontrola: 07.07.2025
V patogenéze hepatitídy B možno identifikovať niekoľko hlavných článkov patogenetického reťazca:
- zavedenie patogénu - infekcia;
- fixácia na hepatocyte a preniknutie do bunky;
- množenie vírusu a jeho „vytlačenie“ na povrch hepatocytov, ako aj do krvi;
- aktivácia imunologických reakcií zameraných na elimináciu patogénu;
- poškodenie orgánov a systémov imunitnými komplexmi;
- tvorba imunity, uvoľnenie z patogénu, zotavenie.
Keďže infekcia hepatitídou B sa vždy vyskytuje parenterálne, možno predpokladať, že moment infekcie je prakticky ekvivalentný prenikaniu vírusu do krvi. Pokusy niektorých výskumníkov rozlíšiť enterálnu a regionálnu fázu pri hepatitíde B sú slabo podložené. Existuje viac dôvodov domnievať sa, že vírus okamžite vstupuje do pečene s prietokom krvi.
Tropizmus vírusu hepatitídy B k tkanivu pečene je predurčený prítomnosťou špeciálneho receptora v HBsAg - polypeptidu s molekulovou hmotnosťou 31 000 Da (P31), ktorý má aktivitu viažucu albumín. Podobná albumínová zóna sa nachádza aj na membráne hepatocytov v pečeni ľudí a šimpanzov, čo v podstate určuje tropizmus HBV k pečeni ľudí a šimpanzov.
Keď vírus prenikne do hepatocytu, uvoľní sa vírusová DNA, ktorá po vstupe do jadra hepatocytu a pôsobení ako matrica pre syntézu nukleových kyselín spustí sériu postupných biologických reakcií, ktorých výsledkom je zostavenie nukleokapsidy vírusu. Nukleokapsida migruje cez jadrovú membránu do cytoplazmy, kde dochádza ku konečnému zostaveniu častíc Dane - kompletného vírusu hepatitídy B.
Treba však poznamenať, že keď je hepatocyt infikovaný, proces môže prebiehať dvoma spôsobmi - replikatívnym a integratívnym. V prvom prípade sa vyvíja obraz akútnej alebo chronickej hepatitídy a v druhom prípade - vírusový nosič.
Dôvody, ktoré určujú dva typy interakcie medzi vírusovou DNA a hepatocytmi, neboli presne stanovené. S najväčšou pravdepodobnosťou je typ reakcie geneticky podmienený.
Výsledkom replikačnej interakcie je zostavenie štruktúr jadrového antigénu (v jadre) a zostavenie kompletného vírusu (v cytoplazme), po ktorom nasleduje prezentácia kompletného vírusu alebo jeho antigénov na membráne alebo v štruktúre membrány hepatocytov.
Všeobecne sa uznáva, že replikácia vírusu nespôsobuje poškodenie buniek na úrovni hepatocytov, pretože vírus hepatitídy B nemá cytopatický účinok. Toto stanovisko nemožno považovať za nespochybniteľné, pretože je založené na experimentálnych údajoch, ktoré síce naznačujú absenciu cytopatického účinku vírusu hepatitídy B, ale boli získané na tkanivových kultúrach, a preto ich nemožno úplne extrapolovať na vírusovú hepatitídu B u ľudí. V každom prípade si otázka absencie poškodenia hepatocytov počas replikačnej fázy vyžaduje ďalšie štúdium.
Avšak bez ohľadu na povahu interakcie vírusu s bunkou je pečeň nevyhnutne zahrnutá do imunopatologického procesu. V tomto prípade je poškodenie hepatocytov spojené so skutočnosťou, že v dôsledku expresie vírusových antigénov na membráne hepatocytov a uvoľnenia vírusových antigénov do voľného obehu sa zapája reťazec postupných bunkových a humorálnych imunitných reakcií, ktorých konečným cieľom je odstránenie vírusu z tela. Tento proces sa vykonáva v plnom súlade so všeobecnými vzormi imunitnej odpovede na vírusové infekcie. Na elimináciu patogénu sa zapájajú bunkové cytotoxické reakcie sprostredkované rôznymi triedami efektorových buniek: K bunkami, T bunkami, prirodzenými zabíjačmi, makrofágmi. Počas týchto reakcií sa infikované hepatocyty ničia, čo je sprevádzané uvoľňovaním vírusových antigénov (HBcAg, HBeAg, HBsAg), ktoré spúšťajú systém tvorby protilátok, v dôsledku čoho sa v krvi hromadia špecifické protilátky, predovšetkým proti jadru - anti-HBc a e-antigénu - anti-HBE. V dôsledku toho dochádza k uvoľneniu pečeňových buniek z vírusu v procese ich smrti v dôsledku reakcií bunkovej cytolýzy.
Zároveň sa špecifické protilátky hromadiace sa v krvi viažu na vírusové antigény a vytvárajú imunitné komplexy fagocytované makrofágmi a vylučované obličkami. V tomto prípade sa môžu vyskytnúť rôzne lézie imunitných komplexov vo forme glomerulonefritídy, arteritídy, artralgie, kožných vyrážok atď. Za účasti špecifických protilátok sa telo očistí od patogénu a dochádza k úplnému uzdraveniu.
V súlade s načrtnutou koncepciou patogenézy hepatitídy B sa všetka rozmanitosť klinických variantov priebehu ochorenia zvyčajne vysvetľuje zvláštnosťami interakcie vírusu a spoluprácou imunokompetentných buniek, inými slovami, silou imunitnej odpovede na prítomnosť vírusových antigénov. Podľa moderných koncepcií je sila imunitnej odpovede geneticky určená a spojená s histokompatibilnými antigénmi lokusu HLA prvej triedy.
Všeobecne sa uznáva, že za podmienok adekvátnej imunitnej odpovede na vírusové antigény sa akútna hepatitída klinicky vyvíja s cyklickým priebehom a úplným zotavením. Na pozadí zníženia imunitnej odpovede na vírusové antigény je imunitne sprostredkovaná cytolýza nevýznamná, preto nedochádza k účinnej eliminácii infikovaných pečeňových buniek, čo vedie k miernym klinickým prejavom s dlhodobou perzistenciou vírusu a prípadne k rozvoju chronickej hepatitídy. Zároveň naopak, v prípade geneticky podmienenej silnej imunitnej odpovede a masívnej infekcie (hemotransfúzia) vznikajú rozsiahle oblasti poškodenia pečeňových buniek, ktoré klinicky zodpovedajú závažným a malígnym formám ochorenia.
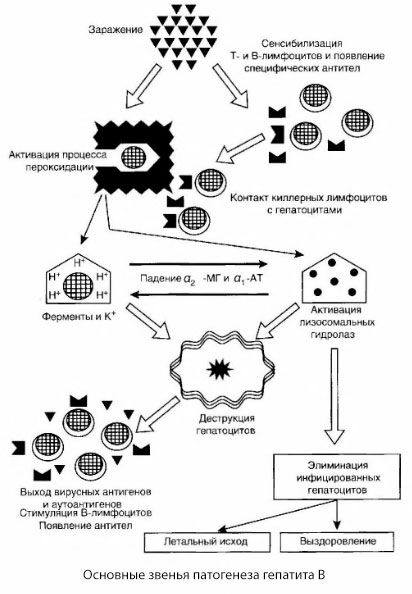
Prezentovaná schéma patogenézy hepatitídy B sa vyznačuje svojou koherentnosťou; obsahuje však množstvo kontroverzných a málo preskúmaných bodov.
Ak sa budeme riadiť konceptom hepatitídy B ako imunopatologického ochorenia, môžeme očakávať zvýšenie bunkových cytotoxicity so zvyšujúcou sa závažnosťou ochorenia. Avšak pri závažných formách sú indexy bunkovej imunity prudko znížené, vrátane viacnásobného poklesu v porovnaní so zdravými deťmi, a indexu cytotoxicity K-buniek. Pri malígnej forme sa počas obdobia vývoja masívnej nekrózy pečene a najmä hepatálnej kómy pozoruje úplná neschopnosť lymfocytov k blastovej transformácii pod vplyvom fytohematultinínu, stafylokokového endotoxínu a HBsAg. Okrem toho neexistuje schopnosť leukocytov migrovať podľa reakcie inhibície migrácie leukocytov (LMIC) a podľa výsledkov ich štúdií s použitím fluorescenčnej tetracyklínovej sondy sa odhalil prudký nárast permeability membrán lymfocytov.
Ak sú teda indexy fluorescencie lymfocytov u zdravých ľudí 9,9 ± 2 % a pri typickej hepatitíde B s benígnym priebehom sa zvyšujú na 22,3 ± 2,7 %, potom pri malígnych formách dosahuje počet fluorescenčných lymfocytov v priemere 63,5 ± 5,8 %. Keďže zvýšenie permeability bunkových membrán je v literatúre jednoznačne hodnotené ako spoľahlivý ukazovateľ ich funkčnej menejcennosti, možno konštatovať, že pri hepatitíde B, najmä pri malígnej forme, dochádza k hrubému poškodeniu lymfocytov. Dôkazom toho sú aj indexy cytotoxicity K-buniek. Pri ťažkej forme je v 1. – 2. týždni ochorenia cytotoxicita 15,5 ± 8,8 % a pri malígnej forme v 1. týždni 6,0 ± 2,6, v 2. týždni 22,0 ± 6,3 % s normou 44,8 ± 2,6 %.
Prezentované údaje jasne naznačujú výrazné poruchy bunkovej imunity u pacientov s ťažkými formami hepatitídy B. Je tiež zrejmé, že tieto zmeny sa vyskytujú sekundárne v dôsledku poškodenia imunokompetentných buniek toxickými metabolitmi a prípadne cirkulujúcimi imunitnými komplexmi.
Ako ukázali štúdie, u pacientov s ťažkými formami hepatitídy B, najmä v prípade rozvoja masívnej nekrózy pečene, sa titer HBsAg a HBeAg v krvnom sére znižuje a zároveň sa začínajú detegovať protilátky proti povrchovému antigénu vo vysokých titroch, čo je úplne netypické pre benígne formy ochorenia, pri ktorých sa anti-HBV objavujú až v 3. až 5. mesiaci ochorenia.
Rýchle vymiznutie antigénov vírusu hepatitídy B so súčasným výskytom vysokých titrov antivírusových protilátok naznačuje intenzívnu tvorbu imunitných komplexov a ich možnú účasť na patogenéze rozvoja masívnej nekrózy pečene.
Faktické materiály nám teda neumožňujú jednoznačne interpretovať hepatitídu B iba z hľadiska imunopatologickej agresie. A nejde len o to, že sa nenašla žiadna súvislosť medzi hĺbkou a prevalenciou morfologických zmien v pečeni na jednej strane a závažnosťou faktorov bunkovej imunity na strane druhej. Teoreticky by sa táto okolnosť dala vysvetliť neskorými štádiami štúdia indikátorov bunkovej imunity, keď boli imunokompetentné bunky vystavené silným toxickým účinkom v dôsledku narastajúcej funkčnej nedostatočnosti pečene. Samozrejme, možno predpokladať, že imunitná cytolýza hepatocytov nastáva v najskorších štádiách infekčného procesu, možno ešte pred objavením sa klinických príznakov závažného poškodenia pečene. Takýto predpoklad je však nepravdepodobný, pretože podobné indikátory bunkovej imunity boli zistené u pacientov s najakútnejším (bleskovým) priebehom ochorenia a navyše počas morfologického vyšetrenia pečeňového tkaniva nebola zistená masívna lymfocytová infiltrácia, pričom zároveň boli zistené súvislé polia nekrotického epitelu bez javov resorpcie a lymfocytovej agresie.
Je veľmi ťažké vysvetliť morfologický obraz akútnej hepatitídy iba z hľadiska imunitnej bunkovej cytolýzy, preto v skorých štúdiách nebol cytotoxický účinok vírusu hepatitídy B vylúčený.
V súčasnosti je tento predpoklad čiastočne potvrdený objavom vírusu hepatitídy B. Ako ukázali štúdie, frekvencia detekcie markerov hepatitídy D priamo závisí od závažnosti ochorenia: v miernych formách sa zistia u 14 %, stredne ťažkých u 18 %, ťažkých u 30 % a malígnych u 52 % pacientov. Vzhľadom na to, že vírus hepatitídy D má nekrozogénny cytopatický účinok, možno považovať za preukázané, že koinfekcia vírusmi hepatitídy B a D má veľký význam pri vývoji fulminantných foriem hepatitídy B.
Patogenézu hepatitídy B možno znázorniť nasledovne. Po preniknutí vírusu hepatitídy B do hepatocytov je imunologický útok na infikované hepatocyty vyvolaný T-zabijakmi, ktoré vylučujú lymfotoxíny smerom k pečeňovým bunkám.
Dôkladné mechanizmy poškodenia hepatocytov pri hepatitíde B ešte neboli objasnené. Hlavnú úlohu zohrávajú aktivované procesy lipidovej peroxidácie a lyzozomálnych hydroláz. Spúšťačom môžu byť lymfotoxíny uvoľňované z efektorových buniek pri ich kontakte s hepatocytmi, ale je možné, že iniciátorom peroxidačných procesov môže byť samotný vírus. Následne sa patologický proces s najväčšou pravdepodobnosťou vyvíja v nasledujúcej postupnosti.
- Interakcia faktora agresie (lymfotoxíny alebo vírus) s biologickými makromolekulami (pravdepodobne so zložkami membrán endoplazmatického retikula schopnými zúčastňovať sa na detoxikačných procesoch, analogicky s inými škodlivými látkami, ako bolo preukázané v súvislosti s tetrachlórmetánom).
- Tvorba voľných radikálov, aktivácia procesov lipidovej peroxidácie a zvýšená permeabilita všetkých hepatocelulárnych membrán (syndróm cytolýzy).
- Pohyb biologicky aktívnych látok pozdĺž koncentračného gradientu - strata enzýmov rôznych intracelulárnych lokalizácií, donorov energie, draslíka atď. Akumulácia sodíka a vápnika v bunkách, posun pH smerom k intracelulárnej acidóze.
- Aktivácia a uvoľňovanie lyzozomálnych hydroláz (RNAázy, DNAázy, katepsínov atď.) s rozpadom pečeňových buniek a uvoľňovaním autoantigénov.
- Stimulácia T- a B-imunitných systémov s tvorbou špecifickej senzibilizácie T-lymfocytov na pečeňové lipoproteíny, ako aj tvorba antihepatických humorálnych autoprotilátok.
V navrhovanej schéme patogenézy hepatitídy B je spúšťacím faktorom vírusové antigény, ktorých intenzívna produkcia sa pozoruje v najskorších štádiách ochorenia a počas celého akútneho obdobia, s výnimkou malígnych foriem, pri ktorých produkcia vírusových antigénov prakticky zaniká v čase vzniku masívnej nekrózy pečene, čo predurčuje rýchly pokles replikácie vírusu.
Je tiež zrejmé, že vírusové antigény aktivujú T- a B-systémy imunity. Počas tohto procesu dochádza k charakteristickej redistribúcii subpopulácií T-lymfocytov, zameranej na organizáciu adekvátnej imunitnej odpovede, elimináciu infikovaných hepatocytov, neutralizáciu vírusových antigénov, sanogenézu a zotavenie.
Keď imunokompetentné bunky interagujú s vírusovými antigénmi na membránach hepatocytov alebo počas reprodukcie vírusu vo vnútri hepatocytu, vznikajú podmienky pre aktiváciu procesov lipidovej peroxidácie, ktoré, ako je známe, riadia permeabilitu všetkých bunkových a subcelulárnych membrán.
Z tejto pozície sa stáva pochopiteľným výskyt cytolýzneho syndrómu, zvýšenej priepustnosti bunkových membrán, ktorá je taká prirodzená a vysoko charakteristická pre vírusovú hepatitídu.
Konečným výsledkom syndrómu cytolýzy môže byť úplné prerušenie oxidačnej fosforylácie, únik bunkového materiálu a odumretie pečeňového parenchýmu.
Avšak vo veľkej väčšine prípadov tieto procesy nenadobúdajú takýto fatálny vývoj. Iba pri malígnych formách ochorenia prebieha patologický proces lavínovito a nezvratne, pretože dochádza k masívnej infekcii, výraznému imunitnému procesu, nadmernej aktivácii peroxidačných procesov a lyzozomálnych hydrodáz a javom autoimunitnej agresie.
Rovnaké mechanizmy sa pozorujú aj pri priaznivom priebehu hepatitídy B, s jedinou zvláštnosťou, že všetky sa realizujú na kvalitatívne odlišnej úrovni. Na rozdiel od prípadov masívnej nekrózy pečene je pri priaznivom priebehu ochorenia počet infikovaných hepatocytov, a teda aj zóna imunopatologickej cytolýzy, menší, procesy lipidovej peroxidácie nie sú tak výrazne zvýšené, aktivácia kyslých hydroláz vedie iba k obmedzenej autolýze s nevýznamným uvoľňovaním autoantigénov, a teda bez masívnej autoagresie, t. j. všetky štádiá patogenézy pri priaznivom priebehu prebiehajú v rámci zachovanej štrukturálnej organizácie pečeňového parenchýmu a sú obmedzené obrannými systémami (antioxidanty, inhibítory atď.), a preto nemajú taký deštruktívny účinok.
Príčiny príznakov intoxikácie pri vírusovej hepatitíde neboli úplne preskúmané. Návrh rozlišovať medzi tzv. primárnou alebo vírusovou intoxikáciou a sekundárnou (výmennou alebo metabolickou) možno považovať za pozitívny, hoci to neodhaľuje hlbší mechanizmus výskytu celkového toxického syndrómu. Po prvé, vírusy hepatitídy nemajú toxické vlastnosti a po druhé, koncentrácia mnohých metabolitov nie vždy koreluje so závažnosťou ochorenia a stupňom prejavov príznakov toxikózy. Je tiež známe, že koncentrácia vírusových antigénov nie je striktne korelovaná so závažnosťou intoxikácie. Naopak, so zvyšujúcou sa závažnosťou ochorenia, a teda so zvyšujúcim sa stupňom toxikózy, koncentrácia HBsAg klesá a je najnižšia pri malígnych formách v čase nástupu hlbokej hepatálnej kómy. Zároveň frekvencia detekcie a titre špecifických antivírusových protilátok priamo závisia od závažnosti ochorenia.
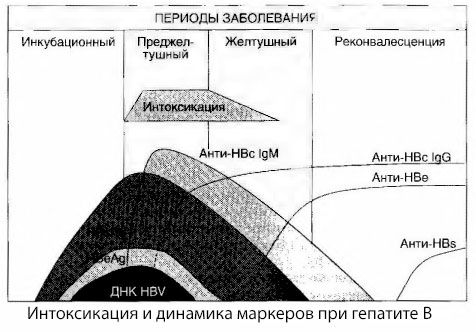
Intoxikácia sa neobjavuje v momente registrácie vírusových antigénov, ale počas obdobia cirkulácie antivírusových protilátok triedy IgM proti kravskému antigénu a antigénu systému E v krvi. Navyše, pri ťažkých a najmä malígnych formách má významná časť pacientov dokonca anti-HBs v krvi, čo sa zvyčajne nikdy nepozoruje pri miernych a stredne ťažkých formách ochorenia.
Prezentované údaje nám umožňujú dospieť k záveru, že syndróm toxikózy pri vírusovej hepatitíde, a najmä pri hepatitíde B, nevzniká v dôsledku výskytu vírusových antigénov v krvi, ale je dôsledkom interakcie vírusových antigénov s antivírusovými protilátkami triedy IgM. Výsledkom takejto interakcie, ako je známe, je tvorba imunitných komplexov a prípadne aj aktívnych toxických látok.
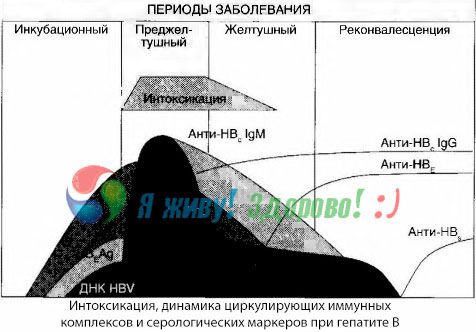
Príznaky intoxikácie vznikajú v momente výskytu imunitných komplexov vo voľnom obehu, ale následne sa takáto korelácia nepozoruje.
Čiastočné vysvetlenie možno nájsť v štúdii zloženia imunitných komplexov. U pacientov s ťažkými formami cirkulujú v krvi prevažne stredne veľké komplexy a v ich zložení na vrchole toxického syndrómu prevládajú protilátky triedy IgG, zatiaľ čo v období poklesu klinických prejavov a rekonvalescencie sa komplexy zväčšujú a v ich zložení začínajú prevládať protilátky triedy IgG.
Prezentované údaje sa týkajú mechanizmov vzniku toxického syndrómu v počiatočnom období ochorenia, ale pri toxikóze vyskytujúcej sa na vrchole klinických prejavov majú len čiastočný význam, a to najmä pri vzniku hepatálnej kómy.
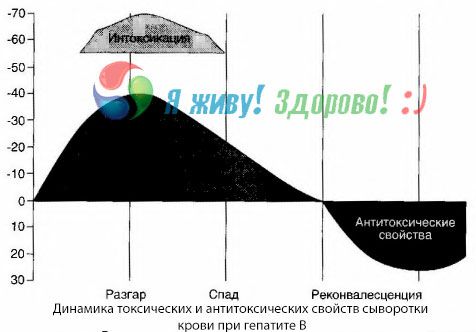
Metóda hemokultúr ukázala, že pri hepatitíde B sa toxíny neustále hromadia v krvi, uvoľňujú sa z poškodeného, rozpadajúceho sa pečeňového tkaniva. Koncentrácia týchto toxínov je úmerná závažnosti ochorenia, majú bielkovinový charakter.
Počas obdobia zotavenia sa v krvi objavujú protilátky proti tomuto toxínu, ale v prípade hepatálnej kómy sa koncentrácia toxínu v krvi prudko zvyšuje a protilátky sa v krvi nezistia.
Patomorfológia hepatitídy B
Na základe povahy morfologických zmien sa rozlišujú tri formy akútnej hepatitídy B:
- cyklická forma,
- masívna nekróza pečene;
- cholestatická pericholangiolytická hepatitída.
Pri cyklickej forme hepatitídy B sú dystrofické, zápalové a proliferatívne zmeny výraznejšie v strede lalôčikov, zatiaľ čo pri hepatitíde A sú lokalizované pozdĺž periférie lalôčika a šíria sa do stredu. Tieto rozdiely sa vysvetľujú rôznymi cestami prenikania vírusu do parenchýmu pečene. Vírus hepatitídy A vstupuje do pečene cez portálnu žilu a šíri sa do stredu lalôčikov, vírus hepatitídy B preniká cez pečeňovú artériu a kapilárne vetvy, ktoré rovnomerne zásobujú všetky lalôčiky až do ich stredu.
Stupeň poškodenia pečeňového parenchýmu vo väčšine prípadov zodpovedá závažnosti klinických prejavov ochorenia. Pri miernych formách sa zvyčajne pozoruje fokálna nekróza hepatocytov a pri stredne ťažkých a ťažkých formách zonálna nekróza (s tendenciou k zlúčeniu a tvorbe mostíkovej nekrózy pri ťažkých formách ochorenia).
Najväčšie morfologické zmeny v parenchýme sa pozorujú na vrchole klinických prejavov, čo sa zvyčajne zhoduje s prvou dekádou ochorenia. Počas druhej a najmä tretej dekády sa regeneračné procesy zintenzívňujú. V tomto období nekrobiotické zmeny takmer úplne miznú a začínajú prevládať procesy bunkovej infiltrácie s pomalou následnou obnovou štruktúry hepatocelulárnych platničiek. Úplná obnova štruktúry a funkcie pečeňového parenchýmu však nastáva až 3 – 6 mesiacov po nástupe ochorenia a nie u všetkých pacientov.
Generalizovaná povaha infekcie pri hepatitíde B je potvrdená detekciou HBsAg nielen v hepatocytoch, ale aj v obličkách, pľúcach, slezine, pankrease, bunkách kostnej drene atď.
Cholestatická (pericholangiolytická) hepatitída je špeciálna forma ochorenia, pri ktorej sa najväčšie morfologické zmeny nachádzajú na strane intrahepatálnych žlčovodov s obrazom cholangiolitídy a pericholangiolitídy. Pri cholestatickej forme dochádza k cholestáze s dilatáciou žlčových kapilár so stázou žlče v nich, s proliferáciou cholangiolov a bunkovými infiltrátmi okolo nich. Pečeňové bunky sú pri tejto forme hepatitídy postihnuté nevýznamne. Klinicky sa ochorenie vyznačuje zdĺhavým priebehom s predĺženou žltačkou. Ukázalo sa, že príčinou takéhoto zvláštneho priebehu ochorenia je prevládajúci účinok vírusu na steny cholangiolov s nevýznamným účinkom na hepatocyty.

